A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou, nesta quinta-feira (16), a aplicação da vacina da Pfizer em crianças de 5 a 11 anos. A farmacêutica Pfizer já tem o registro definitivo de seu imunizante no Brasil. Com a autorização, a bula do imunizante será alterada para inclusão das crianças de 5 a 11 anos.
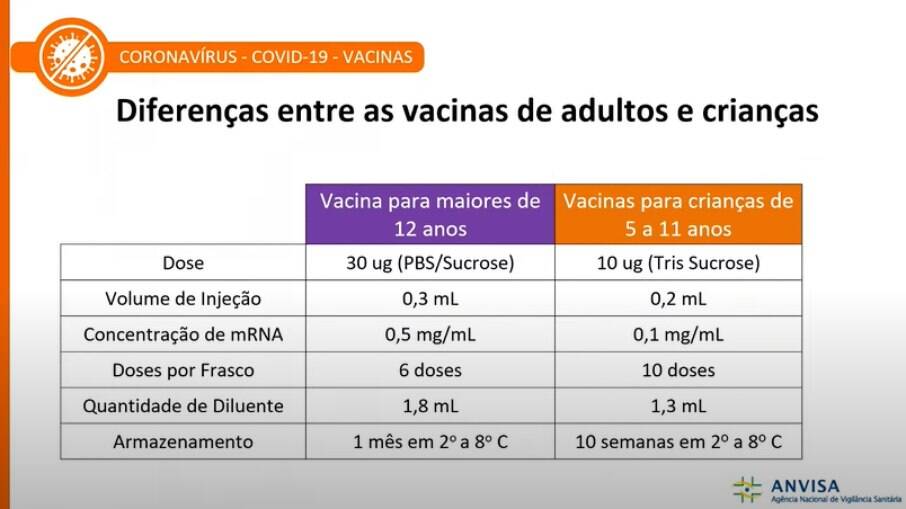
Em comunicado, a Anvisa ainda informou que a vacina que será utilizada para imunizar as crianças será diferente da atual disponível no país. Segundo a área técnica, o imunizante foi adaptado para se adequar aos padrões sanitários e de segurança imunológica. Confira as diferenças na imagem:
"Não há relato de nenhum evento adverso sério, de preocupação, não há relato relacionado a casos muito graves ou mortalidade por conta da vacinação comparado com placebo. Esse perfil de segurança é importante e a gente sabe que essa é uma das maiores preocupações na hora de extrapolar uma vacina para a população pediátrica", afirmou o gerente-geral de Medicamentos e Produtos Biológicosda Anvisa, Gustavo Mendes.
Na avaliação da Anvisa e de especialistas consultados pelo órgão, os riscos da vacinação desta faixa etária superam possíveis riscos. A Anvisa informou ainda que vai continuar fazendo um trabalho de monitoramento conforme a vacinação para o grupo começar.
Leia Também
Os casos graves de Covid-19 entre crianças são mais raros, mas o imunizante ajuda a dar uma proteção mais ampla a essa faixa etária, além de reduzir o risco de que elas se tornem transmissores do vírus.
Diferença entre doses
Para diferenciar as doses das crianças, os frascos serão na cor laranja, diferente do frasco roxa dos adultos. Além disso, o imunizante infantil poderá ser armazenado por 10 semanas de 2°C a 8°C contra quatro semanas da destinada a adultos.
Nos Estados Unidos, a vacina da Pfizer já está liberada para crianças de 5 a 11 anos desde o dia 2 de novembro. A vacina é aplicada em duas doses com três semanas de intervalo nos EUA.
CoronaVac
Nos próximos dias, a Anvisa deve avaliar o pedido do Butantan para usar a Coronavac na imunização de crianças e adolescentes de 3 a 17 anos. O pedido foi recebido, nesta quarta-feira (15), e a Anvisa tem 30 dias para se pronunciar.
