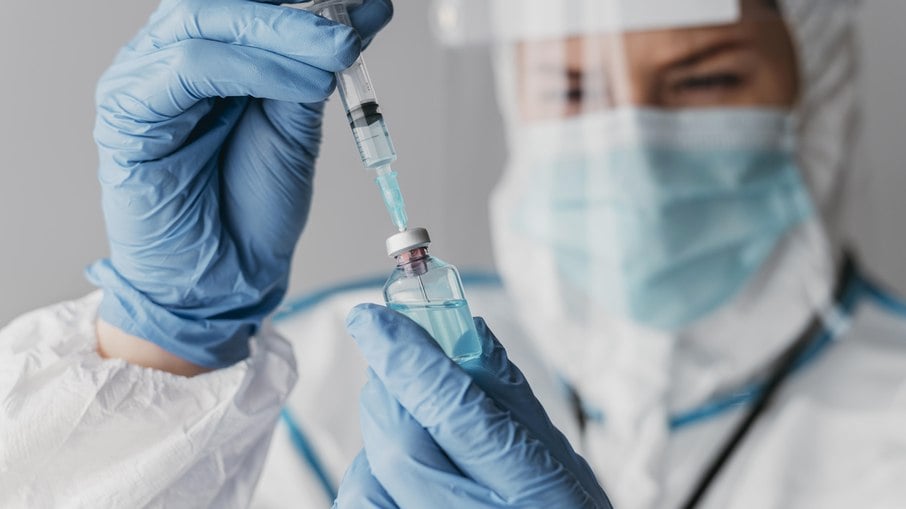
Nesta quinta-feira a Agência Nacional de Vigilância Sanitária (Anvisa) liberou a importação e utilização do antiviral e da vacina Jynneos / Imvanex, o Ministério da Saúde confirmou que a estratégia, no início da campanha, é fornecer a vacina e o antiviral aos profissionais de saúde e os contatos de pessoas próximas a infectados com a varíola símia.
A vacina liberada para uso é produzida pela farmacêutica dinamarquesa Bavarian Nordic. Segundo a decisão da Anvisa, ela poderá ser aplicada em adultos com 18 anos ou mais e tem validade de até 60 meses quando conservada entre -60 a -40°C. O esquema do imunizante é de duas doses, geralmente com intervalo de 28 dias entre elas. É a mesma utilizada nos países que já começaram a campanha para prevenir a infecção pelo vírus monkeypox, como na Europa e nos Estados Unidos.
As primeiras de um total de 50 mil doses da vacina negociadas pelo Brasil são esperadas para o próximo mês, como parte de um acordo com a Organização Pan-americana de Saúde (Opas) para distribuir o imunizante pelos países da América Latina. A estratégia do ministério envolve dar início à campanha com os profissionais de saúde e os contatos de pessoas próximas a infectados com a varíola símia. A OMS, no entanto, não orienta ainda a necessidade de uma vacinação em massa da população.
Para liberar o uso do imunizante pelo ministério sem a necessidade de registro, a Anvisa analisou o relatório de avaliação elaborado pela Food and Drug Administration (FDA), agência reguladora dos Estados Unidos, além de informações da Agência Europeia de Medicamentos (EMA) e da Agência de Segurança da Saúde do Reino Unido (UKHSA). Todas as instituições também deram o aval para aplicação da vacina nos últimos meses.
As primeiras de um total de 50 mil doses da vacina negociadas pelo Brasil são esperadas para o próximo mês, como parte de um acordo com a Organização Pan-americana de Saúde (Opas) para distribuir o imunizante pelos países da América Latina.
Antiviral
No começo de agosto, quando foi anunciado pelo Ministério da Saúde que o Brasil receberia lotes do antiviral Tecovirimat, o ministro da saúde, Marcelo Queiroga também afirmou que os primeiros “contemplados” seriam os “casos mais graves em um primeiro momento”.
O antiviral é um medicamento que trata três infecções causadas pelo vírus da mesma família (ortopoxvírus). Ele previne a varíola, a varíola dos macacos e a varíola bovina. Também é utilizado para tratar complicações que podem ocorrer após a vacinação contra a varíola.
A indicação da Anvisa é para tratamento de adultos, adolescentes e crianças com ao menos 13 kg e deve ser utilizado na fase inicial da infecção, ou seja, entre o primeiro e o quinto dia do aparecimento dos sintomas.
Isso porque a maior eficácia da fórmula é obtida quando a carga viral do vírus da varíola dos macacos está mais alta.
Durante o voto, a diretora relatora da Anvisa, Meiruze Freitas destacou que a agência tem trocado informações com autoridades de outros países que avaliaram o remédio, o que permitiu a rápida conclusão do processo de análise no Brasil.
Ela afirma que o acesso ao medicamento é importante especialmente para os pacientes com maiores riscos de desfechos mais graves da doença, como os imunossuprimidos.
A Anvisa também analisou pareceres da FDA e da EMA sobre a medicação, além da bula do remédio e dados da literatura científica. A agência acrescentou, no entanto, que, tanto em relação ao Tecovirimat, como à vacina, não há solicitações no Brasil para condução de ensaios clínicos.
Na última semana, o órgão já havia caminhado em direção a aprovação das terapias, simplificando o processo que permite a entrada e o uso da vacina e do medicamento no país mesmo sem registro.
Na reunião, os cinco diretores votaram de forma unânime pela aprovação de uma medida regulatória, estruturada durante cerca de um mês, que definiu as regras para que apenas o Ministério da Saúde, que tem previsão legal para dispensa de registro, possa distribuir os tratamentos no Brasil. A decisão, portanto, não se estende a laboratórios e clínicas privadas.
Entre no canal do Último Segundo no Telegram e veja as principais notícias do dia no Brasil e no Mundo. Siga também o perfil geral do Portal iG.
