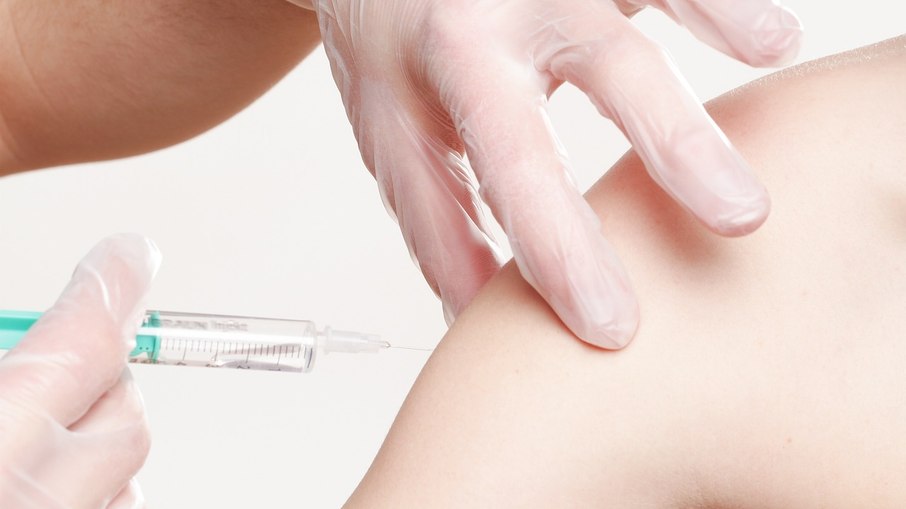
A agência reguladora de alimentos e medicamentos dos Estados Unidos, a FDA, aprovou a primeira vacina que proporciona imunidade contra o vírus sincicial respiratório (VSR) em recém-nascidos.
Desenvolvida pela Pfizer, a vacina é aplicada nas mães durante os estágios finais da gravidez e protege os bebês nos primeiros seis meses após o nascimento.
A vacina chamada de Abrysvo
foi submetida a um estudo com mais de 7 mil gestantes e seus bebês, e demonstrou a redução da necessidade de os recém-nascidos necessitarem de atendimento médico ou hospitalização.
O vírus sincicial respiratório (VSR), pertencente ao gênero pneumovirus afeta principalmente bebês, crianças pequenas e idosos atingindo brônquios e pulmões. Ele representa uma doença frequente sendo a principal responsável por internações hospitalares de bebês e idosos anualmente.
Sua incidência é mais severa durante os meses mais frios do ano, e a última temporada apresentou uma duração excepcional, sobrecarregando os hospitais infantis.
Após um extenso período de investigação e tentativas malsucedidas em desenvolver vacinas contra o VSR, atualmente existem várias alternativas para salvaguardar contra o vírus, incluindo uma vacina recentemente aprovada ,de anticorpos que pode ser administrada a todos os recém-nascidos logo após o parto, bem como novas vacinas destinadas a indivíduos com 60 anos de idade ou mais.
De acordo com a Pfizer, a implementação da vacinação materna poderia reduzir em até 16 mil o número de hospitalizações e mais de 300 mil visitas médicas relacionadas ao VSR a cada ano, se a vacina fosse aplicada de maneira generalizada.
Resultados do estudo da Pfizer
Durante os primeiros três meses após o nascimento, a vacina demonstrou uma eficácia de 82% na prevenção de doenças graves causadas pelo VSR e 57% de eficácia em evitar consultas médicas devido a infecções.
Aos seis meses de vida, a eficácia da vacina contra doenças graves por VSR era de 69%, e sua eficácia na prevenção de consultas médicas relacionadas a problemas respiratórios atingia 51%. Após cerca de seis meses, sua eficácia em manter os bebês longe de consultas médicas era comparável a um placebo.
No início deste ano, os conselheiros de vacinas da FDA votaram unanimemente a favor da eficácia da vacina, e em uma votação de 10 a 4 concordaram que os dados respaldavam sua segurança.
Uma análise realizada pela agência mostrou uma leve proporção maior de partos prematuros em bebês cujas mães receberam a vacina, em comparação com aqueles cujas mães receberam um placebo: 5,7% versus 4,7%, respectivamente.
Contudo, essa diferença não foi considerada estatisticamente significativa.
A Pfizer anunciou que planeja conduzir um amplo estudo de segurança pós-comercialização, utilizando extensas bases de dados de registros comerciais, para avaliar os desfechos de segurança, incluindo o parto prematuro, em todos os indivíduos que receberem a vacina.
A empresa está em processo de avaliação da vacina em crianças de alto risco, com idade entre 2 e 18 anos, bem como em adultos de 18 a 60 anos que apresentam maior suscetibilidade ao VSR devido a condições médicas subjacentes ou um sistema imunológico debilitado.
No Brasil, não há vacinação contra o VSR. Somente no caso das crianças prematuras nascidas com até 28 semanas de gestação ou com fator de risco como bebês com displasia broncopulmonar e cardiopatias congênitas, um programa do Ministério da Saúde oferta o palivizumabe, anticorpo específico contra o vírus sincicial, aplicado uma vez por mês durante cinco meses, antes do período de maior circulação do vírus, para evitar formas graves da doença.
